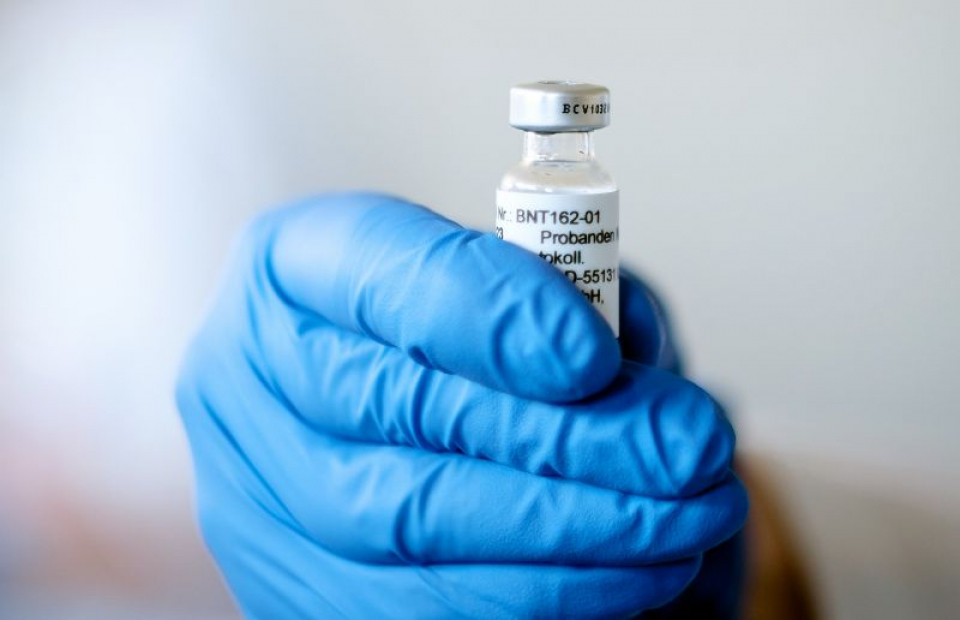
Aprovizionarea cu vaccin pentru Unune Europeană (UE) va fi produsă de fabricile BioNTech din Germania și de fabrica Pfizer din Belgia, și pe baza proiecțiilor actuale, companiile se așteaptă să producă la nivel global până la 1,3 miliarde de doze în 2021.
Pfizer și BioNTech au inițiat o procedură de autorizare continuă către Agenția Europeană a Medicamentului (EMA) în octombrie și vor continua dialogul regulat și deschis cu EMA, oferind rezultate din studiul lor în curs de fază 3, au anunțat cele două companii.
Acordul VACCINURI pentru UE
Pfizer (NYSE: PFE) și BioNTech SE (Nasdaq: BNTX) au anunțat astăzi că au ajuns la un acord cu Comisia Europeană (CE) pentru a furniza Uniunii Europene 200 de doze din vaccinul lor investigațional BNT162b2 pe bază de ARNm împotriva SARS-CoV-2 – COVID-19, cu posibilitatea ca CE să solicite încă 100 de milioane de doze. Se anticipează că livrările vor începe până la sfârșitul anului 2020, sub rezerva succesului clinic și a obținerii autorizației de reglementare de punere pe piață.
Dozele de vaccin pentru Europa vor fi produse în fabricile germane ale BioNTech, precum și în fabricile Pfizer din Belgia. Dacă vaccinul candidat BNT162b2 primește aprobarea Agenției Europene pentru Medicamente (EMA), atunci dozele vor fi comandate de statele membre ale UE care au ales să primească vaccinul ca parte a acestui acord.
„De la debutul pandemiei, prioritatea Pfizer a fost dezvoltarea unui vaccin sigur și eficient, în același timp cu extinderea producției pentru a livra dozele înainte de sfârșitul anului. Acesta este un obiectiv ambițios, dar esențial pentru stoparea acestei pandemii global”, a declarat Albert Bourla, președinte și CEO al Pfizer.
„Acordul de aprovizionare finalizat de astăzi cu Comisia Europeană reprezintă cea mai mare comandă inițială de doze de vaccin pentru Pfizer și BioNTech până în prezent și un pas major către obiectivul nostru comun de a pune la dispoziția populațiilor vulnerabile un vaccin COVID-19”, a mai arătat acesta.
„Ca o companie fondată în inima Europei, așteptăm cu nerăbdare să furnizăm vaccinuri pentru milioane de oameni, după aprobarea acestuia. Dorim să mulțumim Comisiei și statelor membre pentru sprijinul și încrederea acordate în vaccinul nostru candidat pentru COVID-19. Scopul nostru este de a dezvolta un vaccin sigur și eficient pentru a contribui la finalizarea acestei pandemii. Doar prin eforturi comune vom putea face acest lucru ”, a declarat dr Ugur Sahin, CEO și cofondator al BioNTech.
Pfizer și BioNTech au anunțat încheierea unor discuții exploratorii cu Comisia Europeană pentru furnizarea de doze de vaccin candidat BNT162b2, dacă este aprobat, pe 9 septembrie 2020. Acordul de aprovizionare este acum definitiv.
Pe 9 noiembrie 2020, Pfizer și BioNTech au anunțat că vaccinul lor pe bază de ARNm, BNT162b2, împotriva SARS-CoV-2 a demonstrat eficacitate împotriva COVID-19 la participanți fără dovezi prealabile ale infecției cu coronavirus, pe baza primei analize intermediare de eficacitate, efectuată pe 8 noiembrie 2020, de un comitet extern de monitorizare a datelor (DMC) din studiul clinic de fază 3.
DMC a analizat 94 de cazuri. Cazuistica, împărțită în persoane vaccinate și persoane care au primit placebo, indică o rată de eficacitate a vaccinului peste 90%, la 7 zile după a doua doză. Aceasta înseamnă că protecția se realizează la 28 de zile de la inițierea vaccinării, care constă într-un program de administrare a 2 doze. Pe măsură ce studiul continuă, procentul final al eficacității vaccinului poate varia. DMC nu a raportat nicio problemă serioasă de siguranță și recomandă ca studiul să colecteze în continuare date suplimentare privind siguranța și eficacitatea, conform planificării.
Datele vor fi discutate cu autoritățile de reglementare din întreaga lume. Pfizer și BioNTech intenționează să trimită date din studiul complet de fază 3 pentru evaluare peer-review și publicarea în jurnale științifice.
În plus față de angajamentele guvernamentale, Pfizer și BioNTech și-a manifestat interesul pentru posibila aprovizionare a facilității COVAX, un mecanism stabilit de Gavi, Alianța pentru vaccinuri, Coaliția pentru inovații pentru pregătirea pentru epidemii (CEPI) și Organizația Mondială a Sănătății (OMS), care, utilizând o gamă largă de platforme tehnologice, își propune să ofere guvernelor, inclusiv celor de pe piețele emergente, acces timpuriu la un portofoliu mare de vaccinuri candidate COVID-19 produse de mai mulți dezvoltatori din întreaga lume.
Despre vaccinul candidat BNT162
Programul BNT162 se bazează pe tehnologia mRNA, proprietate a BioNTech, și este susținut de Dezvoltarea globală a vaccinurilor Pfizer și de capacitățile sale de producție. Doi dintre cei patru candidați ai vaccinului de investigație - BNT162b1 și BNT162b2 - au primit desemnarea de Fast Track de la Administrația SUA pentru Alimente și Medicamente (FDA), pe baza datelor preliminare din studiile de fază 1/2 care sunt în curs de desfășurare în prezent în SUA și Germania, ca studii de imunogenitate pe animale. În timpul studiilor preclinice și clinice, BNT162b1 și BNT162b2 au apărut ca fiind candidați puternici pe baza evaluărilor siguranței și a răspunsului imun.
Pe 27 iulie 2020, Pfizer și BioNTech au anunțat că, în urma unei analize aprofundate a datelor preclinice și clinice din studiile clinice de fază ½, și în consultare cu Centrul FDA pentru Evaluare și Cercetare Biologică (CBER) și alte autorități de reglementare globale, au selectat candidatul la vaccin BNT162b2 să avanseze într-un studiu de fază 2/3. BNT162b2 codifică o glicoproteină cu vârf complet SARS-CoV-2 optimizată (S), care este ținta anticorpilor neutralizatori de viruși.
Studiul clinic de fază 3 pentru vaccinul candidat BNT162b2 a început pe 27 iulie 2020 și a înscris până în prezent 43.538 de participanți, dintre care 38.955 au primit a doua doză de vaccin candidat începând cu 8 noiembrie 2020. Aproximativ 42% din participanții la nivel mondial și 30% din participanții din SUA au medii diverse etnice și rasiale. Procesul continuă să înscrie și se așteaptă să continue prin analiza finală, atunci când vor fi acumulate un total de 164 de cazuri confirmate de COVID-19.
De asemenea, studiul va evalua potențialul vaccinului candidat la de a oferi protecție împotriva COVID-19 la cei care au avut o expunere anterioară la SARS-CoV-2, precum și prevenirea contra dezvoltării bolii COVID-19 severe.
În plus față de obiectivele primare de eficacitate care evaluează cazuri confirmate de COVID-19 care se acumulează de la 7 zile după a doua doză, analiza finală va include acum, cu aprobarea Administrației SUA pentru Alimente și Medicamente (FDA), noi obiective secundare care evaluează eficacitatea la cazurile care se acumulează la 14 zile după a doua doză.
Fiți la curent cu ultimele noutăți. Urmăriți DCMedical și pe Google News
Te-a ajutat acest articol?
Urmărește pagina de Facebook DCMedical și pagina de Instagram DCMedical Doza de Sănătate și accesează mai mult conținut util pentru sănătatea ta, prevenția și tratarea bolilor, măsuri de prim ajutor și sfaturi utile de la medici și pacienți.